
[摘要] 單克隆抗體(tǐ)技術(shù)在疾病診斷、藥物開發中的應用是目前醫藥領域的一個研究熱(rè)點,也爲多種疾病的治療提供了新的途徑,目前已有多個單抗藥物獲FDA批準上市。本文以PD-1單抗藥物爲例,對該藥物的專利布局進行分(fēn)析,并對單抗藥物在中國(guó)專利審查過程中的支持問(wèn)題進行重點解讀(dú),以期爲我國(guó)醫藥生(shēng)物企業的專利布局和維護專利穩定性提供借鑒。
[關鍵詞] 單克隆抗體(tǐ);PD-1;單抗藥物;支持問(wèn)題;專利布局
一、單克隆抗體(tǐ)靶點 ~ PD-1受體(tǐ)
抗體(tǐ)作(zuò)爲介導體(tǐ)液免疫的重要效應分(fēn)子,是B細胞接受抗原刺激後增殖分(fēn)化爲漿細胞所産生(shēng)的糖蛋白(bái)。由于其在疾病的診斷、免疫防治及基礎研究中的重要作(zuò)用,人(rén)工(gōng)制備抗體(tǐ)技術(shù)已被人(rén)們廣泛關注。1975年(nián),Kohler和Milstein建立了單克隆抗體(tǐ)(Monoclonal Antibody,m Ab)制備技術(shù),使得(de)大(dà)規模制備高特異性、均質性抗體(tǐ)成爲可(kě)能。此技術(shù)是将産生(shēng)特異性抗體(tǐ)的小鼠B細胞與骨髓瘤細胞融合,形成雜交瘤細胞,它既有骨髓瘤細胞大(dà)量擴增和永生(shēng)的特性,又具備免疫B細胞合成和分(fēn)泌特異性抗體(tǐ)的能力。由于來(lái)源于一個 B細胞,故經篩選克隆得(de)到的雜交瘤細胞僅産生(shēng)抗單一抗原表位的特異性抗體(tǐ),稱爲單克隆抗體(tǐ)(以下簡稱單抗)。[1]
1986年(nián),世界上首個單抗藥物--用于治療器官移植出現的排斥反應的抗cd3單抗OKT3獲得(de)美國(guó)FDA的上市批準,由此拉開了單抗藥物發展的序幕。近年(nián)來(lái),單抗藥物在腫瘤、自(zì)身(shēn)免疫病、心血管疾病等領域呈現出迅猛發展的态勢,取得(de)了巨大(dà)的成功,在高投入、高産出、高回報率的理(lǐ)念指引下,國(guó)内外各大(dà)制藥公司均加大(dà)了投入力度。由于抗體(tǐ)藥物具有特異性強、療效顯著及毒性低等特點,在臨床中已被廣泛應用。根據湯森路(lù)透最新數據,全球目前已獲批及進入Ⅲ期臨床研究的抗體(tǐ)類藥物共有243個,其中121個品種已經獲得(de)美國(guó)FDA批準,占創新生(shēng)物抗體(tǐ)藥物的74.23%。如(rú)今,單抗已成爲現代生(shēng)物制藥的重要組成部分(fēn),更是制藥企業争相(xiàng)布局的"金礦産業"。預計(jì)2016年(nián)全球抗體(tǐ)類藥物市場規模已超過1000億美元。[2]
PD-1(細胞程序性死亡受體(tǐ)-1)受體(tǐ)是主要表達在活化T細胞上的免疫抑制性受體(tǐ),與表達在腫瘤細胞表面的配體(tǐ)PD-L1結合,通過降低T細胞的免疫應答,使腫瘤免疫逃逸。[3]随着對PD-1/PD-L通路(lù)的深入研究,其在樹(shù)突狀細胞、T淋巴細胞、B淋巴細胞等中的作(zuò)用逐漸被揭示,應用抗體(tǐ)阻斷PD-1/PD-L信号通路(lù)對腫瘤及慢(màn)性病毒感染等疾病進行生(shēng)物治療已成爲近年(nián)研究的熱(rè)點。[4]以靶向PD-1及其配體(tǐ)PD-L1的單抗藥物爲代表的腫瘤免疫療法被視爲未來(lái)最有前途的腫瘤治療方法之一,曾被美國(guó)《Science》雜志評爲2013年(nián)全球十大(dà)科(kē)學突破性技術(shù)的榜首。腫瘤免疫療法可(kě)以有效地克服現有的腫瘤靶向治療藥物(包括靶向類單抗)的耐藥性問(wèn)題。同時,其未來(lái)最大(dà)的潛力來(lái)自(zì)于與其他(tā)腫瘤療法的聯合使用,包括與化療、放(fàng)療、靶向治療藥物、治療性疫苗的聯合使用。
二、PD-1單抗藥物市場之争
PD-1受體(tǐ)由日(rì)本京都(dōu)大(dà)學本庶佑(Honjo Tasuku)教授于1992年(nián)發現。2005年(nián),日(rì)本小野制藥和美國(guó)Medarex制藥共同合作(zuò)開發Nivolumab(商品名Opdivo®),并于2006年(nián)提交PCT申請(qǐng),公開号爲WO2006121168A1,之後陸續在日(rì)本、美國(guó)、中國(guó)以及歐洲等藥品主流市場獲得(de)授權。2009年(nián),百時美施貴寶斥資24億美元收購(gòu)Medarex制藥,将Nivolumab項目收入囊中,其臨床試驗、知識産權與後續開發權利由百時美施貴寶所主導。2014年(nián)7月4日(rì),Nivolumab獲得(de)PMDA(日(rì)本醫藥品醫療器械綜合機(jī)構)的上市批準,同年(nián)12月22日(rì)獲得(de)FDA(美國(guó)食品藥品監督管理(lǐ)局)的上市批準,2015年(nián)6月19日(rì)獲得(de)EMA(歐洲藥品管理(lǐ)局)的上市批準,并由小野制藥在日(rì)本銷售,百時美施貴寶在美國(guó)和歐洲銷售。該藥批準的适應症爲轉移性黑(hēi)色素瘤,非小細胞肺癌、晚期腎細胞癌、霍奇金淋巴瘤等。
此外,百時美施貴寶的競争對手~默沙東于2009年(nián)收購(gòu)先靈葆雅,獲得(de)MK-3475(即Pembrolizumab,商品名Keytruda®,一種新型的人(rén)源化Ig G4-κ型單克隆抗體(tǐ),通過作(zuò)用于PD-1,阻斷PD-1/PD-L1通路(lù),進而有助于人(rén)體(tǐ)免疫系統攻擊腫瘤細胞)的後續開發權。該藥于2014年(nián)9月4日(rì)獲得(de)FDA的上市批準,又于2015年(nián)7月17日(rì)獲得(de)EMA的上市批準,用于治療轉移性黑(hēi)色素瘤、非小細胞肺癌、晚期黑(hēi)色素瘤。[5]
然而,正當默沙東還(hái)沉浸在Keytruda®獲得(de)FDA批準的喜悅中時,百時美施貴寶一紙訴狀将其告上美國(guó)聯邦法庭:百時美施貴寶及其日(rì)本合作(zuò)夥伴小野制藥稱,PD-1抑制劑的美國(guó)專利由小野制藥獲得(de),并已許可(kě)給美國(guó)百時美施貴寶公司,授權範圍涵蓋該藥物在腫瘤領域的應用,默沙東侵犯了雙方在日(rì)本上市的PD-1抑制劑Opdivo®的專利。據此,百時美施貴寶在起訴書(shū)中要求法院判決該産品侵權。對此,默沙東承認小野制藥确實享有該産品的方法專利,但(dàn)同時表示,該專利是無效的。經過幾番厮殺,2017年(nián)1月,百時美施貴寶在專利糾紛中獲勝,與默沙東達成和解協議(yì),後者支付前者6.25億美元及6.5%銷售提成。百時美施貴寶赢下PD-1專利戰,坐(zuò)享Keytruda®數十億美元銷售分(fēn)成。[6]
百時美施貴寶與默沙東在國(guó)際市場上戰得(de)難解難分(fēn),然後在中國(guó)市場,卻是一片"和平"的景象。截至2017年(nián)4月21日(rì),國(guó)内注冊申報的PD-1單抗藥物的制藥公司共有9家。由于PD-1單抗藥物是一類适應症很廣的腫瘤免疫治療藥物,所以每家制藥公司優先選擇開發的适應症不盡相(xiàng)同(具體(tǐ)情況如(rú)表1所示,數據來(lái)源于"醫藥魔方數據")。
表1 國(guó)内已注冊申報的PD-1抗體(tǐ)及其開發進度

究其原因,不妨來(lái)研究一下百時美施貴寶的日(rì)本合作(zuò)夥伴小野制藥在美國(guó)、歐洲和中國(guó)獲得(de)授權的同族專利的保護範圍。
美國(guó)授權專利 ~ US8728474B2的權利要求1如(rú)下所示:
1. 一種用于治療腫瘤患者的方法,包括給予患者藥物有效量的抗-PD-1單克隆抗體(tǐ)。
歐洲授權專利 ~ EP1537878B1的權利要求1如(rú)下所示:
1. 抑制PD-1的免疫抑制信号的抗-PD-1抗體(tǐ)在制備用于癌症治療的藥物中的應用。
中國(guó)授權專利 ~ CN101213297B的權利要求1如(rú)下所示:
1. 人(rén)單克隆抗體(tǐ)或其抗原結合部分(fēn),
其包含
氨基酸序列如(rú)SEQ ID NO: 18所列的重鏈可(kě)變區CDR1;
氨基酸序列如(rú)SEQ ID NO: 25所列的重鏈可(kě)變區CDR2;
氨基酸序列如(rú)SEQ ID NO: 32所列的重鏈可(kě)變區CDR3;
氨基酸序列如(rú)SEQ ID NO: 39所列的輕鏈可(kě)變區CDR1;
氨基酸序列如(rú)SEQ ID NO: 46所列的輕鏈可(kě)變區CDR2;和
氨基酸序列如(rú)SEQ ID NO: 53所列的輕鏈可(kě)變區CDR3,
其中所述抗體(tǐ)或其抗原結合部分(fēn)與人(rén)PD-1特異性結合。
比較上述權利要求的保護範圍,不難發現小野制藥歐洲授權專利的保護範圍相(xiàng)比于中國(guó)授權專利的保護範圍寬了不少,幾乎是任何人(rén)未經允許将任何PD-1抗體(tǐ)用于任何癌症的治療都(dōu)将落入EP1537878B1的保護範圍内并構成侵權,然而這樣的權利要求在中國(guó)是無法獲得(de)授權的。
三、單抗藥物中國(guó)專利審查中的"支持"問(wèn)題
中國(guó)授權專利 ~ CN101213297B在發明專利申請(qǐng)公布時的權利要求1如(rú)下所示:
1. 分(fēn)離(lí)的人(rén)單克隆抗體(tǐ)或其抗原結合部分(fēn),其中所述抗體(tǐ)與PD-1結合且其中所述抗體(tǐ)展現出至少一種下列性質:
a)以1×10-7 M或更小的KD與人(rén)PD-1結合;
b)不顯著與CD28、CTLA-4或ICOS結合;
c)在混合淋巴細胞反應(MLR)測定法中增加T細胞增殖;
d)在MLR測定法中增加幹擾素γ的産量;或
e)在MLR測定法中增加白(bái)介素-2(IL-2)的分(fēn)泌。
由于該專利申請(qǐng)的年(nián)代較早,因此未能檢索到該專利申請(qǐng)的具體(tǐ)審查檔案,從(cóng)而無法詳細得(de)知中國(guó)授權專利 ~ CN101213297B的權利要求1的具體(tǐ)修改和争辯過程。爲了更清楚地了解單抗藥物專利的中國(guó)審查過程,筆者另舉一個中國(guó)專利申請(qǐng) ~ CN102812047A的實例進行說(shuō)明。
CN102812047A在發明專利申請(qǐng)公布時的權利要求1如(rú)下所示:
1. 分(fēn)離(lí)的抗體(tǐ)或其抗原結合片段, 其與C4.4a的結構域S1特異性結合。
中國(guó)審查員(yuán)在第一次審查意見(jiàn)通知書(shū)中指出:對比文件(jiàn)1(HANSEN L V ET AL, "Production, characterization and use of mono- and polyclonal antibodies against C4.4A, a homologue of the urokinase receptor", 10TH INTERNATIONAL WORKSHOP ON MOLECULAR AND CELLULAR BIOLOGY OF PLASMINOGEN ACTIVATION, 2005, 137)公開了與C4.4的結構域1(即本申請(qǐng)結構域S1)特異性結合的抗體(tǐ)。可(kě)見(jiàn),權利要求1請(qǐng)求保護的技術(shù)方案已被對比文件(jiàn)1公開,且二者屬于相(xiàng)同的技術(shù)領域,能夠解決相(xiàng)同的技術(shù)問(wèn)題,并達到相(xiàng)同的技術(shù)效果。因此權利要求1相(xiàng)對于對比文件(jiàn)1缺乏新穎性。
申請(qǐng)人(rén)在第一次審查意見(jiàn)答複過程中,将具備新穎性的權利要求2-4加入權利要求1中從(cóng)而克服新穎性問(wèn)題,修改後的權利要求1如(rú)下所示:
1. 分(fēn)離(lí)的抗體(tǐ)或其抗原結合片段,其與C4.4a的結構域S1特異性結合,其中所述抗體(tǐ)或抗原結合片段與齧齒動物C4.4a交叉反應,其中所述抗體(tǐ)或其抗原結合片段在與表達C4.4a的細胞結合後被内化,其中所述抗體(tǐ)或抗原結合片段與抗體(tǐ)M31-B01或M20-D02 S-A競争結合C4.4a,
a)其中所述抗體(tǐ)或其抗原結合片段包含與SEQ ID NO: 297 (CDR H1)、SEQ ID NO: 298 (CDR H2)、SEQ ID NO: 299 (CDR H3)一緻的重鏈CDR序列及與SEQ ID NO: 300 (CDR L1)、SEQ ID NO: 22 (CDR L2)、SEQ ID NO: 301 (CDR L3)一緻的輕鏈CDR序列,或者
b)其中所述抗體(tǐ)或其抗原結合片段包含與SEQ ID NO: 302 (CDR H1)、SEQ ID NO: 303 (CDR H2)、SEQ ID NO: 304 (CDR H3)一緻的重鏈CDR序列及與SEQ ID NO: 305 (CDR L1)、SEQ ID NO: 306 (CDR L2)、SEQ ID NO: 307 (CDR L3)一緻的輕鏈CDR序列。
中國(guó)審查員(yuán)未接受上述修改,并在第二次審查意見(jiàn)通知書(shū)中指出:權利要求1采用了各CDR區的共有序列對所述抗體(tǐ)進行了限定。權利要求1限定的共有序列包括了多種序列的組合,其得(de)到的含有六個CDR區的抗體(tǐ)的種類更是多樣。然而包括六個CDR區的抗體(tǐ)的其中一個或多個CDR結構的改變都(dōu)會導緻抗體(tǐ)功能發生(shēng)改變。本領域技術(shù)人(rén)員(yuán)無法預期,除了說(shuō)明書(shū)中所公開的抗體(tǐ)M31-B01(包含如(rú)SEQ ID NO: 5所示HCDR1,如(rú)SEQ ID NO: 9所示HCDR2,如(rú)SEQ ID NO: 13所示HCDR3,如(rú)SEQ ID NO: 17所示LCDR1、如(rú)SEQ ID NO: 21所示LCDR2,以及如(rú)SEQ ID NO: 25所示LCDR3)外,還(hái)有哪些抗體(tǐ)也能解決本發明的技術(shù)問(wèn)題,并達到相(xiàng)同的技術(shù)效果。因此,權利要求1請(qǐng)求保護的技術(shù)方案得(de)不到說(shuō)明書(shū)的支持,不符合專利法第二十六條第四款的規定。
申請(qǐng)人(rén)在第二次審查意見(jiàn)答複過程中,修改了權利要求1,删除了CDR共有序列(SEQ ID NO:s 297-307),并将權利要求3的特征加入權利要求1中以克服支持問(wèn)題,修改後的權利要求1如(rú)下所示:
1. 分(fēn)離(lí)的抗體(tǐ)或其抗原結合片段,其與C4.4a的結構域S1特異性結合,其中所述抗體(tǐ)或抗原結合片段與齧齒動物C4.4a交叉反應,其中所述抗體(tǐ)或其抗原結合片段在與表達C4.4a的細胞結合後被内化,其中所述抗體(tǐ)或抗原結合片段與抗體(tǐ)M31-B01或M20-D02 S-A競争結合C4.4a,
其中所述抗體(tǐ)或其抗原結合片段包含
SEQ ID NO: 75-77所示可(kě)變重鏈CDR序列和SEQ ID NO: 78-80所示可(kě)變輕鏈CDR序列,或者
SEQ ID NO: 5、9和13所示可(kě)變重鏈CDR序列和SEQ ID NO: 17、21和25所示可(kě)變輕鏈CDR序列,或者
......
SEQ ID NO: 45-47所示可(kě)變重鏈CDR序列和SEQ ID NO: 48-50所示可(kě)變輕鏈CDR序列,或者
......
SEQ ID NO: 135-137所示可(kě)變重鏈CDR序列和SEQ ID NO: 138-140所示可(kě)變輕鏈CDR序列。
中國(guó)審查員(yuán)仍未接受上述修改,其在第三次審查意見(jiàn)通知書(shū)中除了指出"抗體(tǐ)的六個CDR區排列順序應一一對應"之外,繼續提出了與第二次審查意見(jiàn)通知書(shū)相(xiàng)同内容的權利要求1缺乏支持的審查意見(jiàn)。
申請(qǐng)人(rén)在第三次審查意見(jiàn)答複過程中,并沒有選擇審查員(yuán)在審查意見(jiàn)中所指出的抗體(tǐ)M31-B01,而是選擇将權利要求1修改爲其想要保護的特定抗體(tǐ)B01-3,修改後的權利要求1如(rú)下所示:
1. 分(fēn)離(lí)的抗體(tǐ)或其抗原結合片段,其與人(rén)C4.4a特異性結合,其中所述抗體(tǐ)或其抗原結合片段包含下列CDR序列:
SEQ ID NO: 45所示的CDR H1,
SEQ ID NO: 46所示的CDR H2,
SEQ ID NO: 47所示的CDR H3,
SEQ ID NO: 48所示的CDR L1,
SEQ ID NO: 49所示的CDR L2,和
SEQ ID NO: 50所示的CDR L3。
該專利申請(qǐng)的說(shuō)明書(shū)第[0043]段和第[0403]段記載:圖6提供了本發明抗體(tǐ)(B01-3)體(tǐ)外抑制腫瘤細胞增殖的數據。在實施例15描述的條件(jiàn)下,與未結合的hIgG1同種型對照(zhào)抗體(tǐ)相(xiàng)比,抗體(tǐ)B01-3使細胞增殖明顯降低。這就(jiù)表明本發明的抗體(tǐ)有效抑制表達C4.4a的細胞的細胞增殖。
最終,審查員(yuán)接受了申請(qǐng)人(rén)的修改,上述權利要求1最終獲得(de)了授權。
通過比較CN102812047A的最終授權的權利要求和CN101213297B的授權權利要求,不難發現,在中國(guó)的專利審查實踐中,對于抗體(tǐ)産品的權利要求,通常要求用說(shuō)明書(shū)中已經驗證的特定抗體(tǐ)的重鏈和輕鏈可(kě)變區中的互補決定區序列來(lái)限定抗體(tǐ)。從(cóng)CN102812047A的審查過程來(lái)看(kàn),這種對抗體(tǐ)權利要求的序列限定,通常是爲了滿足權利要求得(de)到說(shuō)明書(shū)支持的要求。盡管基于已有的限定特征已能夠将請(qǐng)求保護的抗體(tǐ)區别于現有技術(shù),中國(guó)審查員(yuán)通常仍然會要求申請(qǐng)人(rén)将抗體(tǐ)限制爲說(shuō)明書(shū)中給出的特定的6個CDR序列。
從(cóng)上面的實例可(kě)以看(kàn)出,與美國(guó)和歐洲相(xiàng)對較爲寬松的抗體(tǐ)專利授權标準(往往可(kě)以使用功能性限定)相(xiàng)比,中國(guó)對于抗體(tǐ)專利授權标準的要求相(xiàng)對較爲嚴苛,即通常要求用抗體(tǐ)的重鏈和輕鏈的可(kě)變區中的三個高變區(即,互補性決定區,complementarity determining region,CDR)序列進行限定,屬于序列限定型的權利要求。上述審查标準的确立也導緻了隻要中國(guó)企業研發的新PD-1抗體(tǐ)的CDR序列沒有落入上述權利要求的範圍,就(jiù)基本上不存在侵權的問(wèn)題。這也許就(jiù)是PD-1抗體(tǐ)的市場争奪戰在國(guó)際上激戰正酣,而在中國(guó)市場上卻風(fēng)平浪靜(jìng)的重要原因。
四、PD-1抗體(tǐ)藥物國(guó)内外專利布局比較分(fēn)析
不僅美國(guó)和歐洲的抗體(tǐ)專利授權标準與中國(guó)不同,而且美國(guó)和歐洲的制藥公司的抗體(tǐ)藥物專利布局也與中國(guó)不盡相(xiàng)同。
仍以PD-1抗體(tǐ)藥物爲例,原研公司小野制藥、Medarex和百時美施貴寶在布局氨基酸序列的核心專利時,均是通過PCT途徑在全球主要市場同步進行申請(qǐng),并盡量推遲專利公開的時間,以争取在産品上市前1~2年(nián)才讓公衆知曉其專利技術(shù)信息,以盡量減小被侵權的風(fēng)險,同時還(hái)充分(fēn)運用各國(guó)對藥品專利的延長制度,最大(dà)限度延長專利保護時間,例如(rú)公開号爲WO2006121168A1的氨基酸序列專利在美國(guó)獲得(de)授權後還(hái)獲得(de)了413天的延長期;在日(rì)本獲得(de)授權後還(hái)獲得(de)了接近5年(nián)的延長期,并通過對檢測方法(例如(rú)WO2010001617A1,一種評價PD-1抗體(tǐ)治療癌症效果的方法)、聯合用藥(例如(rú)WO2015134605A1,使用PD-1抗體(tǐ)和另一種抗癌劑治療腎癌的方法;WO2016029073A2,PD-1抗體(tǐ)和CD137抗體(tǐ)聯合治療癌症的方法)、醫藥用途(例如(rú)WO2016100561A2,一種PD-1抗體(tǐ)治療神經膠質瘤的方法)等外圍專利的申請(qǐng)進行專利布局,編制龐大(dà)而且牢靠的專利保護網,提高技術(shù)門(mén)檻,爲産品争取最大(dà)的保護強度。
除了原研公司之外,Incyte Corporation、葛蘭素史克、Advaxis、輝瑞等公司主要通過申請(qǐng)聯合用藥專利進行布局(例如(rú)Incyte Corporation 的WO2015119944A1,一種治療腫瘤的方法,包含PD-1拮抗劑和IDO1小分(fēn)子藥物;葛蘭素史克的WO2015088847A1,一種用于治療腫瘤的方法,包含PD-1拮抗劑和VFGFR抑制劑;Advaxis的WO2016011357A1,成細胞的滅活菌株治療前列腺癌的方法;輝瑞的WO2016032927A1,一種治療腫瘤的方法,包含PD-1拮抗劑和ALK 抑制劑(crizotinib)),其将PD-1抗體(tǐ)藥物與本公司的核心産品通過複方制劑的方式進行二次研發,一定程度上繞開了原研公司的專利布局。但(dàn)是這種改進型專利仍然存在一定的侵權風(fēng)險,如(rú)果原研公司提出專利侵權訴訟,法院支持哪一方往往很難一概而論,其中的關鍵在于改進專利的那一方是否能夠拿出足夠的證據證明改進型專利在實施效果方面的顯著優勢,這樣才能證明改進型專利優于原專利而沒有侵犯原專利的權利。[5]
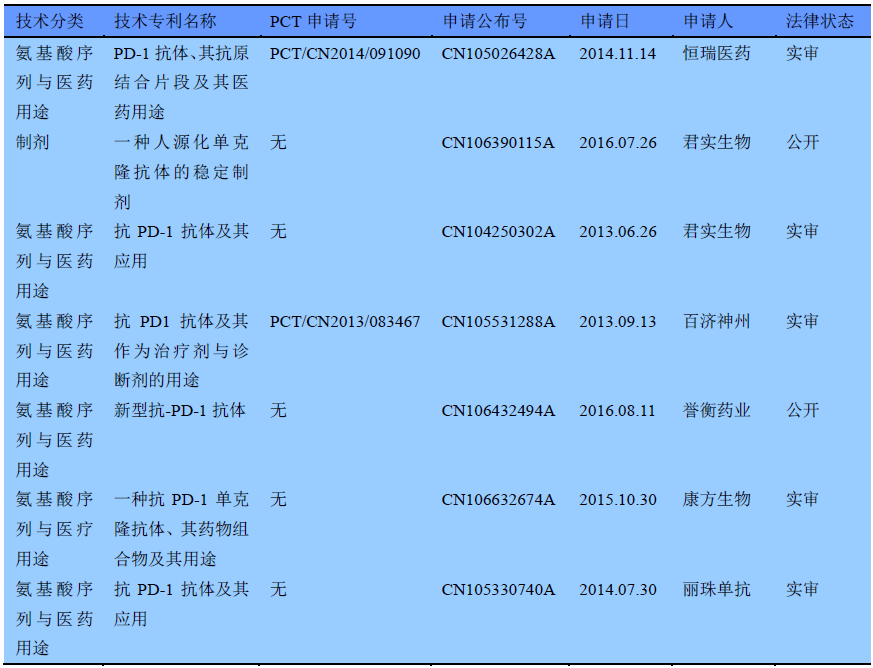
然而,表1中所提及的中國(guó)醫藥生(shēng)物企業對于PD-1抗體(tǐ)的申請(qǐng)主要集中于國(guó)内申請(qǐng),專利申請(qǐng)的技術(shù)分(fēn)類也相(xiàng)對單一,主要集中在氨基酸序列專利和醫藥用途,具體(tǐ)情況如(rú)表2所示。
表2 國(guó)内企業對于PD-1抗體(tǐ)的申請(qǐng)狀況
五、對我國(guó)醫藥生(shēng)物企業的啓示
單克隆抗體(tǐ)技術(shù)在疾病診斷、藥物開發中的應用是目前醫藥領域的一個研究熱(rè)點,也爲多種疾病的治療提供了新的途徑,目前已有多個單抗藥物獲FDA批準上市,例如(rú)可(kě)用于頭頸部腫瘤、結腸癌治療的西妥昔單抗,可(kě)用于乳腺癌、胃食道癌治療的曲妥珠單抗,可(kě)用于治療慢(màn)性淋巴細胞性白(bái)血病的阿侖單抗。由于生(shēng)物醫藥類産品科(kē)技含量高,附加值大(dà),且普适性強,外國(guó)生(shēng)物制藥巨頭一旦研發出新型單抗藥物,就(jiù)要進行專利保護,其保護範圍往往涵蓋全世界大(dà)多數國(guó)家,而中國(guó)作(zuò)爲最大(dà)的市場,更是專利保護的重中之重,故此,我國(guó)醫藥生(shēng)物企業進行研發時已經面臨嚴峻的專利壟斷局面。
目前我國(guó)生(shēng)産單抗藥物的醫藥生(shēng)物企業在專利戰略上需要同時完成兩個主要任務:既要防止外國(guó)生(shēng)物制藥巨頭發起侵權訴訟,又要阻止國(guó)内的後來(lái)者輕易進行仿制。在實施上述專利戰略的過程中,筆者認爲可(kě)以從(cóng)以下幾個方面入手:
①我國(guó)醫藥生(shēng)物企業應增強自(zì)主研發創新意識,積極開發針對新靶點或有效靶點新表位的單抗藥物、積極研發并拓展現有單抗的适應症範圍,并将自(zì)主研發的單抗藥物通過PCT途徑進行專利申請(qǐng),并盡可(kě)能地推遲專利公布的時間,以争取在其産品上市前1~2年(nián)才讓公衆知曉其專利技術(shù)信息,從(cóng)而盡可(kě)能地降低被侵權的風(fēng)險,同時還(hái)可(kě)以充分(fēn)運用各國(guó)對藥品專利的延長制度,最大(dà)限度地延長專利保護時間;
②我國(guó)醫藥生(shēng)物企業在開拓美國(guó)、歐洲等國(guó)外市場時,需時刻關注相(xiàng)關單抗藥物專利的申請(qǐng)情況。由于外國(guó)生(shēng)物制藥巨頭申請(qǐng)文件(jiàn)的權利要求中常常采用功能性限定、序列同源性限定、生(shēng)物來(lái)源限定等各種方式,因此合理(lǐ)界定該單抗藥物在世界各地的保護範圍就(jiù)顯得(de)尤爲重要。在進行充分(fēn)調研後再進行申請(qǐng)可(kě)以最大(dà)程度地确保專利權的穩定性;
③我國(guó)醫藥生(shēng)物企業的知識産權部門(mén)應積極尋找自(zì)身(shēn)已有專利的不足,通過對檢測方法、聯合用藥、醫藥用途等外圍專利的申請(qǐng)進行專利布局,建造牢固的專利保護體(tǐ)系,提高技術(shù)門(mén)檻,爲自(zì)身(shēn)産品争取最大(dà)的保護強度。同時可(kě)以利用"專利權無效宣告"途徑來(lái)破解競争對手的專利圈地;
④我國(guó)醫藥生(shēng)物企業不僅應相(xiàng)互合作(zuò)、聯合研發,降低單抗藥物的研發風(fēng)險,而且應與國(guó)内各大(dà)高校(xiào)、科(kē)研院所加強合作(zuò),進一步推進單抗藥物的産學研相(xiàng)結合,加快(kuài)研究成果的轉化。
[參考文獻]
[1] 陳慰峰, 金伯泉. 醫學免疫學[M]. 人(rén)民(mín)衛生(shēng)出版社, 2004.
[2] 金山(shān). 抗體(tǐ)市場博弈好戲連台. 醫藥經濟報[N]. 2017年(nián)1月9日(rì)(第006版).
[3] 魏木蘭, 王豔林, 秦烨. PD-1/PD-L1抗體(tǐ)在腫瘤臨床治療中的應用. 生(shēng)命科(kē)學[J]. 2016, 28(4): 475-479.
[4] 趙飛龍, 麥海星, 李學超, 陳立軍, 張斌. PD-1/PD-L1信号通路(lù)在免疫細胞中的作(zuò)用及其阻斷抗體(tǐ)在腫瘤治療中的應用. 細胞與分(fēn)子免疫學雜志[J]. 2015, 31(5): 701-703.
[5] 從(cóng)俊傑, 宿央央, 霍春芳, 劉沛然, 彭翠蓮. PD-1/PD-L1抗體(tǐ)的專利分(fēn)析. 今日(rì)藥學[J]. 2017-04-28.
[6] 丁言. PD-1/PD-L1抗體(tǐ)烽煙再起. 醫藥經濟報[N]. 2017年(nián)3月13日(rì)(第F02版).



